Vacunas de Pfizer y BioNTech reciben aprobación de OMS para uso de emergencia
La autorización permitirá el uso de la vacuna a agencias como la Organización Panamericana de la Salud.
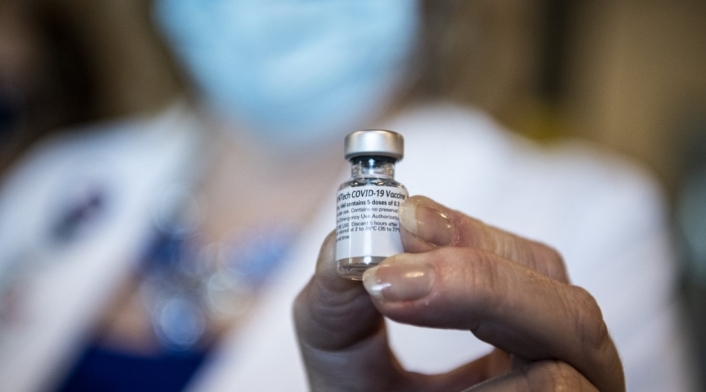
La Organización Mundial de la Salud (OMS) anunció el jueves 31 de diciembre su primera autorización para uso de emergencia de una vacuna contra la covid-19, concretamente la desarrollada por las farmacéuticas Pfizer y BioNTech.
La luz verde a la vacuna, que ya había obtenido este tipo de autorización en mercados como Estados Unidos, el Reino Unido o la Unión Europea, sirve para países que no tienen entidades de homologación de este tipo de productos, por lo que abre la puerta a su uso especialmente en países de desarrollo.
Lea aquí: Pfizer ya radicó ante Colombia solicitud de autorización para su vacuna
La OMS también señaló en un comunicado que la autorización permitirá el uso de la vacuna a agencias como la Organización Panamericana de la Salud o el Fondo de las Naciones Unidas para la Infancia (Unicef).
La OMS ha concedido este permiso cuando la pandemia cumple un año desde que China le notificara la existencia de un nuevo coronavirus, y después de que expertos del organismo con sede en Ginebra revisaran los datos sobre seguridad, eficacia y calidad de la vacuna de Pfizer/BioNTech.
La organización admitió que esta vacuna, con una eficacia de en torno al 95% en los ensayos clínicos, presenta desafíos para su uso, debido a la necesidad de ser almacenada a entre 60 y 90 grados bajo cero.
"Por ello, la OMS trabajará para apoyar a países en el desarrollo de planes de envío y prepararlos en el uso (de la vacuna)", señaló.
Lea además: Tratamiento en Colombia contra Covid-19 recibió aprobación de Invima para fase 2
Vacuna china
De otro lado, China aprobó la primera vacuna, producida por Sinopharm con el Instituto de Productos Biológicos de Pekín, la cual tiene una eficacia del 79%, había indicado el miércoles el grupo farmacéutico.
Con estos resultados, la "Administración Nacional de Productos Médicos aprobó el 30 de diciembre (...) la solicitud de inscripción de la vacuna inactivada de Sinopharm (...) de forma condicional", anunció en conferencia de prensa un alto responsable de este organismo, Chen Shifei. Precisó que el laboratorio debería proseguir ensayos clínicos.




